مقدمه
باتری های قابل شارژ یا سلول های ثانویه به باتری هایی گفته می شود که می توان از آن ها بارها استفاده کرد. باتری های قابل شارژ یک وسیله ذخیره سازی انرژی است که پس از تخلیه با اعمال جریان DC به پایانه های آن می توان دوباره آن را شارژ کرد. به طور کلی باتری های قابل شارژ جایگزین مقعولی برای باتری های غیر قابل شارژ یا همان باتری های اولیه می باشند.
عدم نیاز به جایگزین کردن این باتری در کوتاه مدت و قابلیت بارها استفاده موجب می شود با این که قیمت مصرف کننده ی این باتری ها در ابتدا نسبت به باتری ها ی اولیه بالاتر به نظر برسد ولی در طولانی مدت هزینه ی کمتری برای مصرف کننده خواهد داشت.
ویژگی های باتری های شارژی
از جمله ویژگی های باتری های شارژی می توان به موارد زیر اشاره کرد:
- طول عمر بسیار بالا
- آسیب کمتر به محیط زیست به دلیل تولید ضایعات کمتر
- سازگاری نوع متال هیدرید آن با محیط زیست به دلیل نداشتن مواد سمی در داخل خود
- تنوع بالا در اندازه و ابعاد
- قابل استفاده در انواع وسایل خانگی
انواع باتری های شارژی
باتری های شارژی از نظر ساختمان داخلی و مواد به کار رفته شده در آن به چند دسته تقسیم بندی می شوند :
- نیکل کادمیم
- نیکل متال هیدرید
- لیتیوم یون
- لیتیوم پلیمر
- سرب اسید
3 – 1 نیکل کادمیم (NiCd):
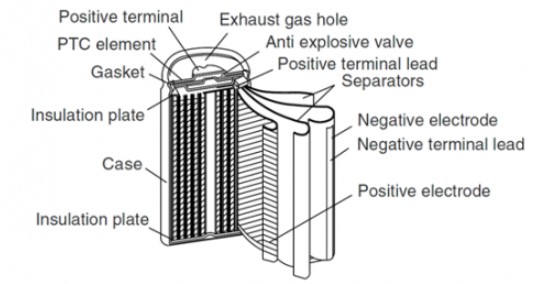
باتری های نیکل کادمیم نوعی از باتری های شارژی هستند که از اکسید نیکل و کادمیم در ساختار آن ها استفاده شده است.
اجزای تشکیل دهنده ی این نوع باتری عبارت است از :
- یک صفحه الکترود مثبت نیکل (III)اکسید-هیدروکسید.
- صفحه الکترود کادمیوم منفی
- یک جدا کننده
- یک الکترولیت قلیایی (هیدروکسید پتاسیم).
فراگیر ترین اندازه ی باتری های شارژی که این ساختار شیمیایی را دارند اندازه ی AA ( باتری قلم) و AAA(باتری نیم قلم ) است . بیشترین کاربرد این نوع باتری ها در لوازم خانگی مثل اسباب بازی ها، جارو های شارژی و تلفن بیسیم است.
ولتاژ نامی این نوع از باتری ها 1.2 ولت می باشد . کمتر بودن ولتاژ نامی نسبت سلول های اولیه ی کربن روی و آلکالاین (ولتاژ نامی سلول های آلکالاین و کربن روی 1.5 می باشد ) باعث می شود که نتوان در همه ی موارد استفاده این نوع از سلول را جایگزین سلول ها ی اولیه کرد.
باید توجه داشت که کادمیم در دسته ی فلز های سنگین قرار میگیرد و همین امر باعث می شود که دفع این نوع باتری ها فرآیندی پیچیده تر و دشوار تر از باتری های اولیه باشد. کادمیم به عنوان یک فلز سنگین ،فلزی سمی و خطرناک برای محیط زیست محسوب می شود و دفع شدن یا سوزانده شدن آن آلودگی بسیار زیادی با خود به همراه دارد. بسیاری از کشور ها امروزه به دنبال بازیافت این نوع سلول ها هستند ولی به طور کلی به علت خطرات ناشی از استفاده از کادمیم این نوع سلول با تکنولوژی نیکل متال هیدرید جایگزین شده است.
3 – 2 نیکل متال هیدرید(NiMH) :
این باتری ها شباهت زیادی به نوع نیکل کادمیم دارند اما حذف کادمیم از ساختار این سلول ها باعث شد تا نوع نیکل متال هیدرید بسیار کم ضرر تر از نیکل کادمیم باشد.
در این نوع سلول ها الکترود مثبت از جنس نیکل اکسید هیدروکسید است و الکترود منفی آن را یک آلیاژ فلزی تشکیل می دهد. این آلیاژ باید خاصیت جذب هیدروژن را داشته باشد. در هنگام شارژ، الکترون ها از الکترود منفی به الکترود مثبت جریان می یابند و هیدروژن را به الکترود مثبت جذب می کنند. در هنگام تخلیه، الکترون ها از الکترود مثبت به الکترود منفی جریان می یابند و هیدروژن را از الکترود مثبت آزاد می کنند.

یکی از مزایای جایگزینی کادمیم با یک آلیاژ فلزی بالا رفتن ظرفیت این سلول تا 2 الی 3 برابر بود . بعلاوه عمر این سلول ها افزایش یافت و به بیش از 1000 چرخه ی شارژ و دشارژ رسید.
واکنش شیمیایی که در الکترود منفی سلول NiMH اتفاق می افتد به صورت زیر می باشد :
H2O + M + e− ⇌ OH− + MH
و واکنش شیمیایی در الکترود مثبت به صورت زیر است :
Ni(OH)2 + OH− ⇌ NiO(OH) + H2O + e−
در هنگام شارژ واکنش ها از چپ به راست اتفاق می افتد و در هنگام دشارژ همین واکنش ها از راست به چپ پیش می روند. دو طرفه بودن واکنش ها خاصیت قابل شارژ بودن را به سلول های ثانویه داده است.
الکترولیت این نوع سلول ها از نوع آلکالاین است و معمولا از پتاسیم هیدروکسید به عنوان الکترولیت استفاده می شود.
3-3 لیتیوم یون :
اختراع و تجاری سازی باتری های لیتیوم یون ممکن است یکی از بزرگترین تأثیرات را در تاریخ تکنولوژی اخیر داشته باشد.
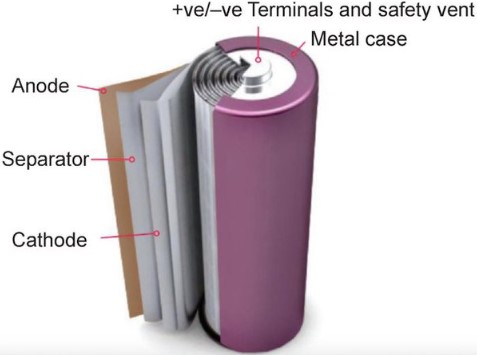
باتری لیتیوم یون نوعی باتری قابل شارژ است که از ترکیب برگشت پذیر یون های Li+ در مواد جامد رسانای الکترونیکی برای ذخیره انرژی استفاده می کند. در مقایسه با سایر باتریهای قابل شارژ تجاری، باتریهای لیتیوم یون چگالی انرژی بالاتر، بازدهی انرژی بالاتر، عمر چرخه طولانیتر و عمر نگه داری در بسته بندی بیشتری دارند.
همانند تمامی باتری ها ، این دسته از باتری ها نیز از سه بخش عمده ی الکترود مثبت، الکترود منفی و الکترولیت ساخته شده اند.
به طور کلی، الکترود منفی یک سلول لیتیوم یون معمولی، گرافیت ساخته شده از کربن است. الکترود مثبت معمولاً یک اکسید فلزی یا فسفات است. الکترولیت یک نمک لیتیوم در یک حلال آلی است. الکترود منفی (که آند در هنگام تخلیه سلول است) و الکترود مثبت (که کاتد در هنگام تخلیه است) توسط جداکننده از اتصال کوتاه می شود. هنگامی که سلول شارژ می شود، الکترودهای منفی و مثبت نقش های الکتروشیمیایی خود (آند و کاتد) را عوض می کنند. با وجود این، در بحث طراحی باتری، الکترود منفی یک سلول قابل شارژ اغلب فقط “آند” و الکترود مثبت “کاتد” نامیده می شود.
بسته به نوع مواد استفاده شده در باتریهای لیتیمی، ولتاژ، چگالی انرژی، طول عمر و ایمنی بهطور قابل توجهی میتواند تغییر کند. در حال حاضر تلاشها برای بهبود عملکرد این باتریها با استفاده از نانوفناوری ادامه دارد. حوضههایی که روی این موضوع کار میکنند: مواد مورد استفاده در الکترودها در مقیاس نانو و دیگر ساختارهای جایگزین الکترود میباشد.
باتریهای لیتیمی نسبت به باتریهای نیکل–کادمیم بسیار گرانتر هستند اما در رنج گرمای بیشتری کار میکنند و چگالی انرژی بیشتری دارند. این باتریها نیاز به مدار محافظ دارند تا ولتاژ پیک رو کنترل کنند.
باتریها رفته رفته و به مرور زمان خود به خود از میزان شارژ آنها کاسته میشود. برای باتریهای لیتیومی امروزی معمولاً این میزان به 1.5 تا ۲ درصد در ماه میرسد. با افزایش دما و وضعیت شارژ باتری این نرخ میتواند افزایش یابد.
3-4 لیتیوم پلیمر:
باتری های لیتیوم پلیمر یا به صورت دقیق تر لیتیوم یون پلیمر دسته ی دیگری از باتری های قابل شارژ هستند که از باتری های لیتیوم یون و لیتیوم فلزی تکامل یافته اند. پلیمرهای نیمه جامد (ژل) بسیار رسانا این الکترولیت را تشکیل می دهند. این باتریها انرژی ویژه بالاتری نسبت به سایر انواع باتریهای لیتیومی ارائه میدهند.
تفاوت اصلی این است که باتری به جای استفاده از یک الکترولیت مایع لیتیوم نمک (مانند لیتیوم هگزافلوئورفسفات، LiPF6) که در یک حلال آلی (مانند EC/DMC/DEC) نگهداری می شود، از یک الکترولیت پلیمری جامد (SPE) مانند پلی اتیلن گلیکول (PEG)، پلی اکریلونیتریل (PAN)، پلی (متیل متاکریلات) (PMMA) یا پلی (وینیلیدین فلوراید) (PVdF) استفاده می کند.
اساس کار باتری های لیتیوم پلیمر همانند باتری های لیتیوم یون بر اساس حذف یونهای لیتیوم از یک ماده الکترود مثبت و یک ماده الکترود منفی است. برای جلوگیری از تماس مستقیم الکترودها با یکدیگر، یک جداکننده ریز متخلخل در بین آن قرار دارد که فقط به یون ها و نه ذرات الکترود اجازه می دهد از یک طرف به طرف دیگر مهاجرت کنند.
الکترولیت های پلیمری را می توان به دو دسته بزرگ تقسیم کرد: الکترولیت های پلیمری جامد خشک (SPE) و الکترولیت های پلیمری ژل (GPE).
در مقایسه با الکترولیتهای مایع و الکترولیتهای آلی جامد، الکترولیت پلیمری مزایایی مانند افزایش مقاومت در برابر تغییرات حجم الکترودها در طول فرآیندهای شارژ و تخلیه، بهبود ویژگیهای ایمنی را ارائه میدهد. همچنین انعطاف پذیری و پردازش پذیری عالی دارند. سلول های لیتیوم پلیمر این اجازه را به سازندگان می دهند تا به شکل دلخواه در بیایند و برای کاربرد های متنوع و گسترده قابل استفاده شوند.
ولتاژ نامی این نوع حدود 3.6 یا 3.7 ولت است ولی از 4.2 ولت شارژ کامل در نظر گرفته می شود و وقتی وقتاژ به 3 تا 2.7 ولت کاهش می یابد باتری را تخلیه کامل در نظر می گیرند. دامنه ی کاربرد این تکنولوژی از باتری های قابل شارژ از مصارف خانگی مثل اسباب بازی ها و بالگرد های کوچک ، باتری های تلفن های همراه،تبلت و لپ تاپ تا مصارف بزرگتر مثل باتری ماشین های هیبریدی را شامل می شود. باتری های لیتیوم یون به طور فزاینده ای در سیستم های منبع تغذیه بدون وقفه (UPS) رایج تر می شوند. آنها مزایای بی شماری را نسبت به باتری VRLA سنتی ارائه می دهند و با بهبود پایداری و ایمنی، اعتماد به این فناوری در حال افزایش است. نسبت توان به اندازه و وزن آنها به عنوان یک مزیت بزرگ در بسیاری از صنایعی که نیاز به پشتیبان گیری انرژی حیاتی دارند، از جمله مراکز داده که در آن فضا اغلب در بالاترین حد است، دیده می شود.
3-5 سرب اسید :
باتری های سرب اسیدی از جمله باتری هایی هستند که معمولا برای منبع تغذیه ی بالا استفاده می شود. این باتری به صورت عمده در خودرو ها استفاده می شود. باتری های سرب اسید ابعاد بزرگ و وزن نسبتا بالایی دارند. این نوع باتری به دلیل توانایی ذخیره ی انرژی بالا در منابع تغذیه ی برق اضطراری نیز کاربرد دارند.
باتری های سرب اسید به طورعمده به دو دسته تقسیم می شوند :
- باتری های سرب اسید تر
- باتری های سرب اسید خشک
باتری های سرب اسید تر در گذشته بیشتر رایج بوده اند و اکنون کاربرد زیادی ندارند. اغلب تجهیزات جدید به ویژه برخی از انواع ups ها از نوع سیلد اسید خشک هستند.
اجزای تشکیل دهنده ی باتری های سرب اسیدی :
- درب و دیواره ی پلاستیکی که سطح خارجی آن را پوشانده است.
- جداکننده ی صفحات که مانند عایق عمل میکند.
- صفحات الکترو فعال منفی یا کاتد (NAM)
- صفحات الکترو فعال مثبت یا آند (PAM)
- اتصالات سربی
- الکترولیت
این باتری ها کاربرد های فراوانی دارند از جمله:
- باتری منابع تغذیه یو پی اس
- باتری تجهیزات مخابراتی
- باتری تجهیزات پزشکی
- باتری ویلچر برقی
- باتری لیفتراک برقی
- باتری سیستمهای خورشیدی
- باتری مدار فرمان درب های اتوماتیک
4 – بازیافت باتری ها :
مواد شیمیایی استفاده شده در باتری های قابل شارژ برای محیط زیست بسیار خطرناک بوده بنابر این بهترین راه برای باتری های غیر قابل مصرف بازیافت آن ها می باشد.
باتری های نیکل کادمیم که امروزه بسیار استفاده ی محدودی دارند و با باتری های نیکل متال هیدرید جایگزین شده اند، یکی از خطرناک ترین انواع باتری برای محیط زیست به شمار می روند. کادمیم از دسته ی فلزات سنگین به شمار می رود که برای محیط زیست و سلامت انسان خطر بزرگی است لذا این نوع از باتری ها جمع آوری میشد، در مراکز بازیافت کادمیم آن تا 99 درصد به چرخه باز می گشت و دوباره در باتری های دیگر استفاده می شد.
باتری های نیکل متال هیدرید که عمر بیشتری نسبت به باتریهای نیکل-کادمیم دارند و برای محیطزیست خطر زیادی ندارند، با روشهای مکانیکی بازیافت میشوند. پلاستیک، هیدروژن و نیکل از یکدیگر جدا میشود. نیکل پس از بازیافت در ساخت فولاد ضد زنگ استفاده میشود.
باتری های لیتیوم یون بیشترین طول عمر را در بین باتری های شارژی دارند و فرایند بازیافتی به صرفه نیز دارند. بازیافت این باتریها به روش تجزیۀ حرارتی یا پیرولیز انجام میشود و طی این فرایند مقادیری کبالت، آهن و مس به دست میآید. این مواد در صنایع ذوب آهن، کارخانههای سیمان و راهسازی کاربرد دارند.
باتری های سرب اسید نیز نیاز به بازیافت دارند . در بازیافت باتریهای سرب اسیدی، سرب، پلاستیک (عموماً پلیپروپیلن) و اسید موجود در این باتریها جداسازی میشود. سرب جداشده از باتریها در عملیات حرارتی برای تولید باتریهای جدید آماده میشود. پلاستیکها نیز پس از شستوشو در فرایندی به گرانول کهنه تبدیل و به کارخانههای تولید پلاستیک فرستاده میشوند. اسیدهای آنها نیز پس از خالصسازی به چرخۀ مصرف باز میگردد.





بدون دیدگاه